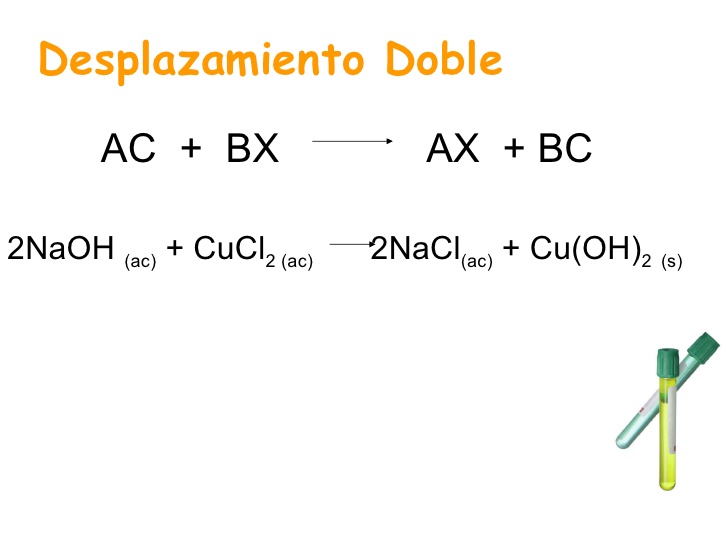
Reacciones de doble desplazamiento
Las reacciones de doble desplazamiento, también conocidas como reacciones de doble reemplazo o metátesis, son un tipo de reacción química en la que dos compuestos reaccionan, y los iones positivos (catión) y los iones negativos (anión) de los dos reactivos cambian de lugar, formando dos nuevos compuestos o productos1.
El patrón general de las reacciones de doble desplazamiento se ve así:
Puedes pensar en estas reacciones como si se intercambiaran los cationes o los aniones, pero no ambos al mismo tiempo, ya que terminarías con las mismas sustancias con las que comenzaste. El solvente en las reacciones de doble desplazamiento casi siempre es agua, y los reactivos y productos normalmente son compuestos iónicos, aunque también pueden ser ácidos o bases2.
Un ejemplo de una reacción de doble desplazamiento es la siguiente:
En este ejemplo, los cationes son Ba^{2+} y Na^+, y los aniones son Cl^- y SO_4^{2-}. Si intercambiamos los aniones o los cationes, obtenemos como productos BaSO_4 y NaCl. ¡No olvides la estequiometría
Además, existen dos tipos comunes de reacciones de doble desplazamiento:
- Reacciones de precipitación: Suceden cuando dos compuestos iónicos acuosos forman un nuevo compuesto iónico que no es soluble en agua. Por ejemplo, la reacción entre el nitrato de plomo (II) y el yoduro de potasio:
En esta reacción, se forma un sólido dorado (PbI_2) a partir de dos soluciones traslúcidas2.
- Reacciones de neutralización: Ocurren cuando un ácido y una base reaccionan para formar agua y una sal. Por ejemplo, la reacción entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH):
En esta reacción, se forma agua y cloruro de sodio (sal) como productos
Comments
Post a Comment